...
--> Tóm tắt
--> Mở đầu
--> Nội dung và phương pháp nghiên cứu
--> Kết quả
--> Thảo luận
...
HIỆU QUẢ CỦA CÁC CHƯƠNG TRÌNH TIÊM PHÒNG SALMONELLA THỰC NGHIỆM TRONG VIỆC PHÒNG NGỪA SALMONELLA GALLINARUM Ở GÀ MÁI NÂU THƯƠNG PHẨM VÀ GÀ MÁI GIỐNG HƯỚNG THỊT
(EFFICACY OF SEVERAL SALMONELLA VACCINATION PROGRAMS AGAINST EXPERIMENTAL CHALLENGE WITH SALMONELLA GALLINARUM IN COMMERCIAL BROWN LAYER AND BROILER BREEDER HENS)
Tác giả: Paiva, JB de1, Penha Filho, RAC1, Argüello, YMS1, Silva, MD da1, Gardin, Y2, Resende, F3, Berchieri Junior, A1, Sesti, L3
1Khoa Bệnh lý Gia cầm. FCAV/UNESP, Jaboticabal, SP,Brazil
2CEVA SANTÉ ANIMALE – Libourne Cedex, Pháp, 35501
3CEVA SAÚDE ANIMAL – Paulínia – SP – Brazil
.
TÓM TẮT
Hiệu quả bảo hộ của các chương trình tiêm phòng Salmonella thực nghiệm trong việc phòng ngừa Salmonella Gallinarum (chủng SGNalr ở 12 tuần tuổi) được đánh giá qua hai thí nghiệm.
Trong thí nghiệm 1, gà mái nâu thương phẩm được tiêm phòng theo một trong những chương trình sau:
(i) hai mũi vắc-xin chứa vi khuẩn SE (Layermune SE; nhóm 1);
(ii) mũi đầu tiên là vắc-xin sống dòng SG9R (Cevac SG9R), sau đó là mũi vắc-xin vi khuẩn SE (Layermune SE; nhóm 2);
(iii) sử dụng hai loại vắc-xin vô hoạt đa giá chứa vi khuẩn SE với một mũi mỗi loại (Corymune 4 & Corymune 7; nhóm 3)
(iv) nhóm đối chứng (nhóm 4).
Trong thí nghiệm 2, gà mái giống được bố trí thí nghiệm tương tự nhưng không thực hiện chương trình tiêm phòng sử dụng vắc-xin đa giá.
Nhìn chung, trong cả hai thí nghiệm, khi phối hợp vắc-xin đều cho hiệu quả trong việc làm giảm tỉ lệ chết sau khi công cường độc với chủng SG. Và chương trình tiêm phòng với mũi đầu tiên là vắc-xin sống dòng SG9R, sau đó vài tuần là mũi vắc-xin vô hoạt chứa vi khuẩn SE cho hiệu quả bảo hộ cao nhất (p<0.05).
Nói tóm lại, chương trình tiêm phòng Salmonella sử dụng vắc-xin vi khuẩn SE hay phối hợp với vắc-xin sống dòng SG9R có hiệu quả trong việc làm giảm tỉ lệ chết khi bị nhiễm SG. Tuy nhiên, điều quan trọng phải nhấn mạnh rằng chương trình tiêm chủng để phòng ngừa các type huyết thanh của Salmonella sẽ chỉ có hiệu quả tốt nhất khi trang trại gia cầm có áp dụng chương trình an toàn sinh học rõ ràng và toàn diện trong việc kiểm soát.Salmonella.
.
MỞ ĐẦU
Salmonella enterica serovar Gallinarum (SG) là tác nhân gây bệnh Thương hàn Gà, đây là bệnh nhiễm khuẩn toàn thân nghiêm trọng trên gà và một số loài chim khác (Shivaprasad, 2000). Salmonella Gallinarum là vi khuẩn không di động, chủ yếu gây bệnh trên gia cầm nuôi ở mọi độ tuổi với đặc trưng: gan và lách bị triển dưỡng trầm trọng, đi kèm với bệnh tích gan có màu đồng, thiếu máu và nhiễm trùng huyết (Shivaprasad, 2000). Triệu chứng của bệnh thay đổi phụ thuộc vào số lượng và đường đi của vi khuẩn xâm nhập vào cơ thể và phụ thuộc vào sự mẫn cảm của giống gà (Oliveira và cộng sự, 2005).
S. Gallinarum chủ yếu tấn công vào hệ thống thực bào đơn nhân và xâm nhập vào bên trong đại thực bào của gan và lách. SG có thể được tìm thấy trên đường tiêu hóa giai đoạn sớm sau khi bị nhiễm qua đường miệng hay ở giai đoạn cuối khi những con gà đang chết dần (Barrow và cộng sự, 1994; Wigley và cộng sự, 2002). Về dịch tể học, con đường lây lan quan trọng nhất của bệnh thương hàn là truyền ngang, và rất ít thông tin đề cập đến sự lây nhiễm mầm bệnh qua trứng (Hall, 1949). S. Gallinarum thường làm chết gia cầm mẫn cảm hay bài thải vi khuẩn ở gia cầm khỏe mang trùng trong ba đến bốn tuần đầu tiên sau khi nhiễm, đôi khi xảy ra hiện tượng nhiễm trùng liên tục (Wigley và cộng sự, 2002; Wigley, 2004).
Tỉ lệ bệnh và tỉ lệ chết do bệnh thương hàn gà có thể lên đến 80%. Bệnh này đã không còn xuất hiện ở Úc, Bắc Mỹ và hầu hết các nước châu Âu áp dụng chương trình an toàn sinh học nghiêm ngặt với quy trình kiểm soát cụ thể về tiêm phòng và thực hiện tốt vấn đề quản lý. Tuy nhiên, bệnh thương hàn gà vẫn là mối nguy hàng đầu ở một số nước châu Phi, châu Á, Trung và Nam Mỹ (Pomeroy & Nagajara, 1991; Lee và cộng sự, 2003). Phương pháp hiệu quả nhất để kiểm soát bệnh này là thực hiện an toàn sinh học nghiêm ngặt kết hợp với quy trình quản lý và khử trùng (Calnek và cộng sự, 1997). Loại bỏ các gia cầm chết ra khỏi môi trường nuôi nhằm làm giảm tỷ lệ tử vong / tỉ lệ bệnh là biện pháp rất hiệu quả để kiểm soát bệnh Thương hàn Gà (Oliveira và cộng sự, 2005).
Tiêm chủng để phòng bệnh hay làm giảm tỉ lệ nhiễm Salmonella ở gà đang được thực hiện ở khắp nơi trên thế giới. Ở Brazil hiện nay đang có vắc-xin chứa vi khuẩn Salmonella Enteritidis (SE) và vắc-xin sống nhược độc Salmonella Gallinarum. Ngành công nghiệp chăn nuôi gà mái thương phẩm và gà thịt ở Brazil dần dần chấp nhận việc tiêm phòng thường xuyên như là biện pháp can thiệp dự phòng với mục đích làm giảm sự hiện diện của Salmonella trong các trang trại chăn nuôi.
Vắc-xin SE chứa toàn bộ vi khuẩn đã bị bất hoạt và nằm lơ lửng trong môi trường chất bổ trợ nước-trong-dầu hay nhôm hydroxít Al(OH)3. Vắc-xin này kích thích tạo ra nhiều kháng thể lưu hành trong máu ở gà mái và tồn tại trong suốt quá trình đẻ trứng (Timms và cộng sự, 1990; Barbour và cộng sự, 1993; Timms và cộng sự, 1994). Các vắc-xin SE cũng cung cấp sự bảo hộ chéo chống lại S. Gallinarum và các type huyết thanh khác. Tuy nhiên, cũng có một số nhược điểm của vắc-xin như chi phí tiêm phòng, các phản ứng phụ ngay sau khi tiêm (phản ứng mô tại vị trí tiêm xảy ra do việc giải phóng nội độc tố từ thành tế bào khi vi khuẩn bị phân giải trong cơ thể gia cầm) (Nakamura và cộng sự, 1994).
Để phòng ngừa bệnh thương hàn gà, có thể sử dụng vắc-xin bất hoạt Salmonella và vắc-xin sống SG dòng 9R (Lee và cộng sự, 2005). Vắc-xin chết có thể làm giảm sự hiện diện của Salmonella ở gia cầm. Chúng an toàn vì không có độc tính cao, không lưu hành trong môi trường và cung cấp sự bảo hộ vừa đủ để bảo vệ cho đàn gia cầm chăn nuôi với quy mô lớn (Barrow và cộng sự, 1991; De Buck và cộng sự, 2004). Tuy vậy, vắc-xin sống được cho là có lợi thế hơn trong việc hình thành đáp ứng miễn dịch trong cơ thể (Van Immerseel và cộng sự, 2005). Vắc-xin sống kích thích cả hệ miễn dịch trung gian tế bào và hệ miễn dịch dịch thể để tạo ra tất cả các “vũ khí” cần thiết để chống lại Salmonella, trong khi những vắc-xin bất hoạt khác chỉ kích thích chủ yếu vào sự sản xuất kháng thể chống lại các kháng nguyên có sẵn, không thay đổi đang hiện diện trong cơ thể gà (Collins, 1974; Gast và cộng sự, 1993; Barrow & Wallis, 2000). Một nguyên nhân khác nữa là vắc-xin chết nhanh chóng bị phá hủy và loại thải ra khỏi cơ thể; đồng thời chúng cũng không thể kích hoạt các tế bào T gây độc (Barrow & Lovell, 1991; Nagajara & Rajashekara, 1999). Miễn dịch qua trung gian tế bào được xem là quan trọng hơn đáp ứng miễn dịch dịch thể trong việc bảo vệ cơ thể chống lại Salmonella, nhất là nhiễm các type chỉ gây bệnh trên một loài vật chủ cụ thể (Collins, 1974; Mastroeni và cộng sự, 1993; Van Immerseel và cộng sự, 2005; Barrow, 2007).
Chủng 9R của SG thường được tiêm vào đàn gia cầm ở các nước có dịch thương hàn gà đang hoành hành (Smith, 1956; Shivaprasad, 2000). Chủng 9R bắt đầu được sử dụng và phát triển từ những năm 1950, có cấu trúc lipo-polysaccharide bán tổng hợp nhằm làm giảm độc lực của vi khuẩn (Smith, 1956 a,b; Silva và cộng sự, 1981; Silva, 1984; Faberwee và cộng sự, 2001a,b). Vắc-xin này cũng cung cấp một số sự bảo vệ chống lại Salmonella Enteriditis và Salmonella Typhimurium (Barrow và cộng sự, 1991; Audisio & Terzolo, 2002; Tan và cộng sự, 2008ab). Vắc-xin SG9R cho thấy sự an toàn và hiệu quả chấp nhận được trên gà mái tơ ngay cả khi được chủng ngừa vào 4 tuần tuổi (Lee và cộng sự, 2005). Ngoài ra, không có bằng chứng cho thấy sự bài thải dòng vi khuẩn này qua phân (Feberwee và cộng sự, 2000). Tuy nhiên, có một vài báo cáo về dòng vắc-xin SG9R có bài thải qua phân trong vòng 24 giờ sau khi tiêm phòng (Silva và cộng sự, 1981).
Vắc-xin sống dòng 9R kích hoạt hệ thống miễn dịch trung gian tế bào và miễn dịch dịch thể ở gà và cả hai hệ thống này cung cấp sự bảo hộ cao nhất cùng lúc. Sau khi tiêm phòng, số lượng vi khuẩn giảm hoàn toàn tại tuần thứ ba và đây cũng là thời điểm tăng số lượng kháng thể kháng-Salmonella lưu hành, tăng nhanh số lượng tế bào T gây độc tác động trực tiếp vào tế bào Salmonella và tăng sự hiện diện của interferon gamma (Wigley và cộng sự, 2005).
Một số nhà cung cấp giống và gà mái thương phẩm đã tiêm phòng vắc-xin sống SG hay ST ngay từ giai đoạn gà mái tơ, sau đó được phòng ngừa thêm vắc-xin SE vào cuối giai đoạn nuôi (Nassar và cộng sự, 1994; Schaller, 1996; Cookson & Maiers, 2004). Sự phối hợp vắc-xin sống và chết không được nghiên cứu tại thời điểm đó, nhưng phạm vi bảo hộ chống lại các type huyết thanh khi phối hợp vắc-xin sẽ rộng hơn nhiều so với khi chỉ sử dụng vắc-xin sống hoặc vắc-xin bất hoạt trong việc kiểm soát sự bảo hộ sau khi công cường độc SG.
.
NỘI DUNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
Gà
Gà mái nâu thương phẩm hướng trứng (giống Dekalb white; Granja Planalto, Uberlândia, MG, Brazil) được sử dụng trong thí nghiệm 1. Giống này có sự mẫn cảm cao với Salmonella Gallinarum (Berchieri Jr. và cộng sự, 2000; Freitas và cộng sự, 2007). Trong thí nghiệm 2, sử dụng gà mái giống hướng thịt (giống Cobb500; Cobb-Vantress Brasil, Guapiaçu-SP-Brazil). Tất cả các gà mái này được lựa chọn lúc một ngày tuổi, được chăn nuôi và cho ăn theo khẩu phần phù hợp với khuyến cáo của nhà cung cấp giống của mỗi loại.
Trước khi thực hiện thí nghiệm, tất cả gà được kiểm tra để chỉ chọn những con không có sự hiện diện của Salmonella sp và kháng thể kháng SE.
Tất cả gà trong cùng thí nghiệm được nuôi trong một trại duy nhất:
- Thí nghiệm 1: mỗi nhóm chia thành 5 chuồng với 6 con/chuồng
- Thí nghiệm 2: mỗi nhóm chia thành 4 chuồng với 5 con/chuồng
Thí nghiệm 2 được thực hiện trước, sau đó sẽ có một vài tuần làm trống chuồng để lau dọn và khử trùng trước khi Thí nghiệm 1 bắt đầu.
Vắc-xin
Tất cả vắc-xin sử dụng là các vắc-xin thương phẩm được cung cấp bởi CEVA-Phylaxia (Cevac Corymune 4K & 7K; Budapest, Hungary), CEVA Biomune (Layermune SE; Lenexa, USA) và CEVA Campinas (Cevac SG9R; Campinas, Brazil).
Cevac Corymune 4K là vắc-xin bất hoạt đa giá chứa vi khuẩn Avibacterium paragallinarum chủng A, B và C, và vi khuẩn Salmonella Enteritidis với chất bổ trợ nhôm hydroxit và chất bảo quản thiomersal. Cevac Corymune 7K là vắc-xin bất hoạt đa giá tổ hợp 3 chủng A, B, C của vi khuẩn Avibacterium paragallinarum (gây bệnh Sổ mũi truyền nhiễm - Coryza), vi-rút gây bệnh Dịch tả gà (ND: Newcastle Disease) dòng La Sota, Viêm phế quản truyền nhiễm (IB: Infectious Bronchitis) dòng Massachusetts, Hội chứng giảm đẻ (EDS: Egg Drop Syndrome’76) dòng B8/78 và vi khuẩn Salmonella Enteritidis với chất bổ trợ nhũ tương dầu và chất bảo quản thiomersal. Layermune SE là vắc-xin bất hoạt chứa toàn bộ vi khuẩn (bacterin) của nhiều dòng được lựa chọn thuộc Salmonella Enteritidis (SE) trong nhũ tương dầu. Cevac SG9R là vắc-xin sống chứa dòng 9R của vi khuẩn Salmonella Gallinarum (chứa ít nhất 107 CFU mỗi liều) đã được làm nhược độc và không gây bệnh cho gà, ở dạng đông khô.
Vào 5 và 9 tuần tuổi, gà ở mỗi nhóm được tiêm phòng qua đường tiêm bắp ở mô cơ ức (đối với Cevac Corymune 4K & 7K và Layermune SE) hay qua đường tiêm dưới da ở phần dưới lưng cổ (Cevac SG9R) như khuyến cáo của nhà sản xuất.
Công cường độc
Dòng Salmonella Gallinarum 9S độc lực phân lập từ gà bệnh được sử dụng để công cường độc. Một đột biến ngẫu nhiên kháng axít nalidixic (SGNalr) được sử dụng để làm vi khuẩn phục hồi lại độc lực của nó.
Dòng vi khuẩn này được nuôi cấy trong môi trường canh LB (DIFCO-244620), ủ qua đêm trong lò ấp và được lắc đều với tần số 100 rev / phút ở 37oC trong 24 giờ. Môi trường này sẽ chứa khoảng 8 x 108 CFU (colony forming units: số đơn vị khuẩn lạc) trong 1ml. Lúc 12 tuần tuổi, tất cả gà được cho uống trực tiếp 2ml dung dịch canh này để công cường độc.
Bố trí thí nghiệm
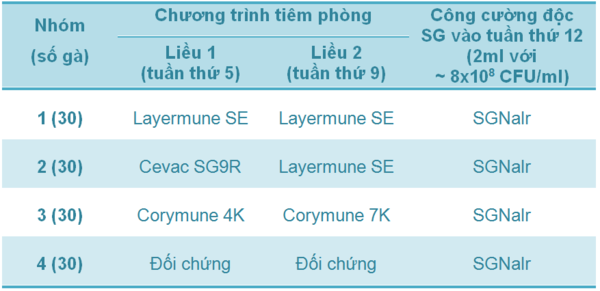
Bảng 1 - Thí nghiệm 1 - Chương trình tiêm phòng và công cường độc SG ở các nhóm gà đẻ thương phẩm
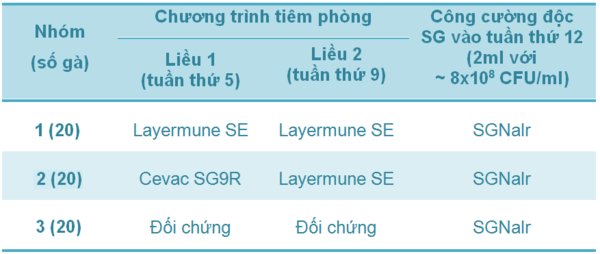
Bảng 2 - Thí nghiệm 2 - Chương trình tiêm phòng và công cường độc SG ở các nhóm gà đẻ giống
Trong cả hai thí nghiệm, tỉ lệ chết được ghi nhận đến ngày thứ 28 kể từ ngày công cường độc và được phân tích bằng trắc nghiệm Chi-Bình phương (p<0.05).
.
KẾT QUẢ
Trước khi bắt đầu thí nghiệm, tất cả gà ở hai thí nghiệm cho phản ứng âm tính với Salmonella spp.
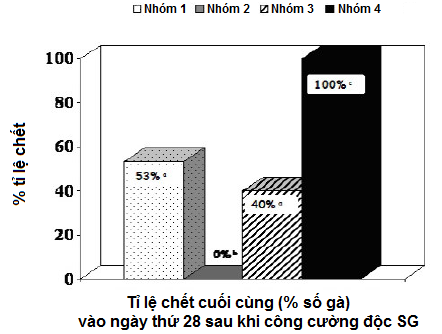
Thí nghiệm 1: Dữ liệu tỉ lệ tử vong tích lũy trong đàn gà mái nâu thương phẩm được trình bày trong Bảng 1 và Sơ đồ 1. Tỉ lệ chết giảm đáng kể ở nhóm gà được tiêm phòng bằng vắc-xin vô hoạt SE (Nhóm 1 và Nhóm 3; p<0.05). Và không có gà nào bị chết trong nhóm được tiêm phòng 2 mũi với vắc-xin sống SG9R (Cevac SG9R) và vắc-xin bất hoạt SE (Layermune SE).
Sơ đồ 1 - Tỉ lệ tử vong tích lũy theo % của gà mái nâu thương phẩm trong bốn tuần sau khi công cường độc với Salmonella Gallinarum (với khác biệt thống kê [p<0.05])
Bảng 1 - Tỉ lệ tử vong tích lũy trong đàn gà mái nâu thương phẩm được tiêm phòng ở tuần thứ 5 và tuần thứ 9, sau đó được công cường độc với Salmonella Gallinarum ở tuần thứ 12 (với khác biệt thống kê [p<0.05])
Thí nghiệm 2: Dữ liệu tỉ lệ tử vong tích lũy trong đàn gà mái giống được trình bày trong Bảng 2 và Sơ đồ 2. Cả hai chương trình tiêm phòng vắc-xin đều làm giảm tỉ lệ chết trong suốt 4 tuần sau khi công cường độc. Tuy nhiên, sự bảo hộ đáng kể (tỉ lệ chết thấp; p<0.05) chỉ có ở những con được tiêm chủng lần đầu với vắc-xin sống SG9R (Cevac SG9R) và lần thứ hai với vắc-xin bất hoạt SE (Layermune SE).
Sơ đồ 2 - Tỉ lệ tử vong tích lũy theo % của gà mái giống trong bốn tuần sau khi công cường độc với Salmonella Gallinarum (với khác biệt thống kê [p<0.05])
Bảng 2 - Tỉ lệ tử vong tích lũy trong đàn gà mái giống được tiêm phòng ở tuần thứ 5 và tuần thứ 9, sau đó được công cường độc với Salmonella Gallinarum ở tuần thứ 12 (với khác biệt thống kê [p<0.05])
.
THẢO LUẬN
Nguồn lây lan chủ yếu của S. Gallinarum trong trại gà là do các gà bị nhiễm và lây truyền ngang; do đó, sự hiện diện của vi khuẩn này trong đàn gà có thể được kiểm soát bằng các phương pháp an toàn sinh học tiêu chuẩn cho đến hạn chế tối đa sự tiếp xúc với các đàn gà bị nhiễm, con người, dụng cụ và các thiết bị khác có thể là nguồn lây lan mầm bệnh (Shivaprasad, 2003). Tuy nhiên, trong các trang trại có áp lực bị nhiễm cao, đặc biệt là các trại có nhiều lứa tuổi gà, tiêm phòng được xem là phương pháp kiểm soát bổ sung và hiệu quả (Barrow, 2007).
Vắc-xin chết được sử dụng để kiểm soát sự hiện diện của Salmonella trong các trại gà cho kết quả không cố định và loại này chỉ bảo hộ cho gà ở mọi lứa tuổi chống lại các các type huyết thanh không gây bệnh thương hàn (Timms và cộng sự, 1994). Tuy nhiên, chúng có thể làm giảm đáng kể số lượng mặc dù không bài thải hoàn toàn vi khuẩn ra khỏi cơ thể gà (Gast và cộng sự, 1993), có lẽ vì chỉ một mình hệ thống miễn dịch dịch thể hoạt động không phải là sự bảo vệ đầy đủ chống lại SE do sự bảo hộ hoàn hảo khỏi Salmonella đòi hỏi phải kích hoạt cả hai hệ thống miễn dịch: dịch thể và trung gian tế bào (Miyamoto và cộng sự, 1999). Mặc dù vậy, các đổi mới gần đây của công nghệ sử dụng chất bổ trợ đang rất hứa hẹn cho sự phát triển hoàn toàn an toàn của vắc-xin bất hoạt Salmonella và có khả năng đem lại sự kích thích mạnh mẽ đến hệ thống miễn dịch nhằm tạo ra các vũ khí bảo vệ khác nhau trong cơ thể gà (Barrow, 2007).
Có ý kiến cho rằng hệ thống miễn dịch qua trung gian tế bào quan trọng hơn miễn dịch dịch thể trong việc tiêu diệt hoàn toàn Salmonella trong mô, trong khi đáp ứng miễn dịch dịch thể dường như chỉ tập trung làm giảm sự xâm nhiễm ở ruột (Hassan & Curtiss 1994; Barrow & Wallis, 2000; Babu và cộng sự, 2004). Một loại vắc-xin lý tưởng nên tạo ra sự bảo hộ trên toàn bộ cơ thể và niêm mạc bằng sự kích thích hiệu quả lên cả hai hệ thống đáp ứng miễn dịch (Van Immerseel et al., 2005). Mặc dù một vài tác giả khác (Barrow & Wallis, 2000; Meyer et al., 1992, Zhang-Barber, 1999) chứng minh rằng các vắc-xin chết Salmonella chỉ gây ra một phần đáp ứng miễn dịch, nhưng trong thời điểm nghiên cứu của chúng tôi, sự đáp ứng này đã vừa đủ ngăn ngừa và làm giảm đáng kể tỉ lệ chết trong các nhóm gà chỉ sử dụng vắc-xin bất hoạt SE (p<0.05). Phát hiện này rất thú vị vì cùng một loại vắc-xin được tạo ra nhằm chống lại SE lại được chứng minh có hiệu quả đáng kể trên SG (Penha Filho và cộng sự, dữ liệu chưa được công bố). Salmonella Gallinarum và Salmonella Enteritidis thuộc cùng một type huyết thanh (D1) và có cùng kiểu kháng nguyên thân “O” (1,9,12; Ewing,1986) nên có thể hiểu vì sao lại có sự bảo hộ chéo khi tiêm phòng vắc-xin SE lại chống được cả SG (Kingley & Baumler, 2000). Điều này cũng chứng minh rằng các vắc-xin Salmonella có khả năng tạo miễn dịch chéo đối với các thành viên trong cùng một type huyết thanh. Khả năng vắc-xin SE bảo hộ chéo chống lại các Salmonella khác đã được chứng minh thực tế tại châu Mỹ La-tinh (Norton & Lozano, 1997). Trong một dịch bệnh xảy ra do nhiễm SG trong đàn gà mái, tỉ lệ chết tích lũy do bệnh thương hàn gà ở các đàn được tiêm phòng vắc-xin SE thấp hơn đáng kể trong suốt 11 tuần (8.1% tỉ lệ chết; Norton and Lozano, 1997).
Theo Liu và cộng sự (2001), vắc-xin vô hoạt có thể làm giảm sự bài thải SE qua phân và sự giảm này phụ thuộc vào thành phần của vắc-xin. Một nghiên cứu thực hiện bởi Barbour và cộng sự (1993) so sánh sáu vắc-xin vô hoạt SE và thấy rằng chúng làm giảm sự bài thải SE qua phân với các mức độ khác nhau. Một nghiên cứu của Freitas và cộng sự (2008) so sánh ba vắc-xin SE cũng cho kết quả tương tự. Các tác giả này kết luận rằng các yếu tố khác nhau trong vắc-xin có thể là nguyên nhân gây ra hiện tượng này, như loại chất bổ trợ, thành phần vắc-xin, dòng Salmonella Enteritidis sử dụng, phương pháp bất hoạt,… Các yếu tố này có thể giải thích tại sao lại có kết quả bảo hộ khác nhau trong nhóm gà được tiêm phòng với Layermune SE hay với Corymune trong thí nghiệm 1, mặc dù trong nghiên cứu của chúng tôi, các gà được công cường độc bằng SG chứ không phải bằng SE. Có khá ít thông tin về hiệu quả của vắc-xin vi khuẩn bất hoạt Salmonella Gallinarum. Trong bài báo gần đây của Haider và cộng sự (2007), đề cập đến vắc-xin vi khẩn SG được sản xuất từ các dòng phân lập từ môi trường có khả năng chuyển đổi huyết thanh đáng kể, chứ không đề cập đến thông tin về sự bảo vệ chống lại tác nhân gây bệnh thí nghiệm.
Trong thí nghiệm của chúng tôi, sự bảo vệ tốt nhất ở nhóm được tiêm phòng với vắc-xin sống dòng SG 9R. Việc tiêm phòng vắc-xin có type huyết thanh Salmonella gây bệnh trên vật chủ cụ thể với triệu chứng toàn thân nghiêm trọng sẽ tạo ra đáp ứng miễn dịch bảo hộ mạnh và đặc hiệu cho chính type huyết thanh đó (Smith, 1956; Barrow & Wallis, 2000).
Phần lớn nghiên cứu (Smith, 1956; Harbourne, 1957; Gordon & Luke, 1959; Gordon và cộng sự, 1959; Lee và cộng sự, 2005) chứng minh rằng dòng vắc-xin SG9R là dòng hiệu quả trong việc phòng ngừa bệnh thương hàn gà. Tỉ lệ chết ở các gà rất mẫn cảm với dòng S. Gallinarum độc lực được giới hạn khi tiêm chủng bằng vắc-xin SG9R (Silva và cộng sự, 1981). Lee và cộng sự (2005) thấy rằng vắc-xin dòng 9R cung cấp sự bảo hộ tuyệt vời và an toàn khi tiêm phòng cho gà 4 tuần tuổi. Thêm vào đó, với nghiên cứu của chúng tôi, gà tiêm phòng dưới da dòng SG9R không thấy biểu hiện bệnh sau khi công cường độc bằng dòng độc lực cao SGNalr ở cả hai giống gà khảo sát.
Chúng tôi cũng không tìm thấy bất kì sự khác biệt nào trong việc bảo hộ khi tiêm phòng vắc-xin SG9R giữa hai thí nghiệm thực hiện. Tuy nhiên, chương trình tiêm phòng với hai liều vắc-xin bất hoạt SE (Layermune SE + Layermune SE) lại cho hai hiệu quả khác nhau, có thể cho thấy tính mẫn cảm khác nhau đối với bệnh thương hàn gà ở hai giống gà khảo sát. Kết quả này cũng tương tự như kết quả đã được mô tả bởi Gordon và cộng sự (1959). Điều này có nghĩa trong vài thập niên gần đây, xu hướng tiến hóa gene của dòng gà thương mại không ảnh hưởng nhiều đến sự mẫn cảm với SG. Mặc dù Bumstead và cộng sự (1993) nhận xét rằng khả năng miễn dịch đối với Salmonella của bộ gene hiện đại ở các dòng gà thương phẩm đã thay đổi so với bộ gene lúc đầu.
Có khá ít thông tin tập trung vào vấn đề kiểm soát bệnh thương hàn gà qua các chương trình tiêm phòng vắc-xin sống và bất hoạt phù hợp. Tuy vậy, các thí nghiệm khác nhau đã được công bố chỉ ra rằng chương trình kết hợp vắc-xin sống (dòng SG9R) và vắc-xin bất hoạt Salmonella có thể cho kết quả rất tốt chống lại SE ở đàn gà đẻ (Nassar và cộng sự, 1994; Schaller, 1996; Cookson & Maiers, 2004). Không thể so sánh trực tiếp nghiên cứu của chúng tôi với các nghiên cứu trước đây khi đề cập đến SE vì chương trình tiêm phòng và vắc-xin sử dụng giữa các nghiên cứu khá khác nhau. Tuy nhiên, trên quan điểm kết hợp sử dụng hai loại vắc-xin: đầu tiên là vắc-xin sống, sau đó vài tuần là vắc-xin bất hoạt cho kết quả rất đáng được xem xét trong việc ngăn ngừa bệnh thương hàn gà.
Kết luận, đàn gà được tiêm phòng vắc-xin bất hoạt SE hay kết hợp với vắc-xin sống SG9R sẽ tạo ra mức độ bảo vệ khác nhau để làm giảm tỉ lệ chết do nhiễm khuẩn SG, và kết quả còn phụ thuộc vào chương trình tiêm phòng đang sử dụng. Chỉ sử dụng vắc-xin bất hoạt, sẽ làm giảm đáng kể tỉ lệ chết trên gà mái nâu nhưng không có ảnh hưởng gì đến gà mái giống hướng thịt. Và khi kết hợp vắc-xin, với mũi đầu là vắc-xin sống SG9R và mũi thứ hai sau đó vài tuần là vắc-xin bất hoạt SE là chương trình tiêm phòng hiệu quả nhất.
Tuy nhiên, cũng cần phải nhấn mạnh rằng chương trình tiêm phòng chống lại các type huyết thanh Salmonella sẽ chỉ phát huy tác dụng cao nhất nếu trại cũng đang thực hiện chương trình an toàn sinh học rõ ràng và toàn diện trong việc kiểm soát Salmonella.
.
TÀI LIỆU THAM KHẢO
Audisio MC, Terzolo HR. Virulence Analysis of a Salmonella gallinarum strain by oral inoculation of 20-day-old chickens. Avian Diseases 2002; 46:186-191.
Babu U, Dalloul RA, Okamura M, Lillehoj HS, Wie H, Raybourne RB, Gaines D, Hekert RA. “Salmonella enteritidis Clearance and Immune Response in Chickens Following Salmonella Vaccination and Challenge.” Veterinary Immunology and Immunopathology 2004; 101(3- 4):251-7.
Barbour EK, Wayne WN, Nabbut NH, Poss PE, Brinton MK. Evaluation of bacterins containing three predominant phage types of Salmonella enteritidis for prevention of infection in egg laying chickens. American Journal of Veterinary Research 1993; 54:1306-1309.
Barrow PA. Salmonella infection: immune and non-immune protection with vaccines. Avian Pathology 2007; 36(1):1-13.
Barrow PA, Lowell MA, Berchieri Jr A. The use of two live attenuated vaccines to immunize egg-laying hens against Salmonella enteritidis phage type 4. Avian Pathology 1991; 20:681-692.
Barrow PA, Lowell MA. Experimental infection of egg-laying hens with Salmonella enteritidis phage type 4. Avian Pathology 1991; 20:335-348.
Barrow PA, Wallis TS. Vaccination against Salmonella infections in food animals: rationale theoretical basis and practical applications In: Wray C, Wray A, editors. Salmonella in domestic animals. New York: CABI Publishing; 2000. p.323-339.
Berchieri Jr A, Oliveira GH, Pinheiro LAP, Barrow PA. Experimental Salmonella Gallinarum infection in light laying hens lines. Brazilian Journal of Microbiology 2000; 31:50-52.
Bumstead N, Barrow P. Resistance to Salmonella gallinarum S. pullorum and S. enteritidis in inbred lines of chickens. Avian Diseases 1993; 37:189-193.
Calnek BW, Barnes HJ, Beard CW, MsDougald LR, Saif YM. Pullorum diseases and fowl typhoid. In: Shivaprassad HN, editor. Disease of poultry. 10th ed. Ames: Iowa State University Press; 1998. p. 220-228.
Collins FM. Vaccines and cell-mediated immunity. Bacteriology Review 1974; 38(4):371-402.
Cookson KC, Maiers JD. SE protection of commercial layers vaccinated with attenuated live S typhimurium boosted with killed SE bacterin then challenged during molt” a portion of a presentation. USAHA 108'h Annual Meeting Greenville; 2004 oct 21-24; Guenville, NC.
De Buck J, Van Imerseel F, Haeseberouck F, Ducatelle R. Effect of type fimbriae of Salmonella enterica serotype Enteritidis on bacteraemia and reproductive tract infection in laying hens. Avian Pathology 2004; 33:314-320.
Ewing WH. Edwards and Ewing's identification enterobacteriaceae. 4th ed. New York: Elsevier; 1986.
Feberwee A, Hartman EG, De Wit JJ, De Vries TS. The spread of Salmonella gallinarum 9R vaccine strain under field conditions. Avian Diseases 2001a; 45:1024-1029.
Feberwee A, de Vries TS, Hartman EG, de Wit JJ, Elbers AR, de Jong WA. Vaccination Against Salmonella enteritidis in Dutch Commercial Layer Flocks with a Vaccine Based on a live Salmonella gallinarum 9R strain: Evaluation of Efficacy Safety and Performance of Serologic Salmonella Tests”. Avian Diseases 2001b; 45:83-91.
Freitas OC, Arroyave W, Alessi AC, Fagliari JJ, Berchieri Jr A. Infection of commercial laying hens with Salmonella Gallinarum: Clinical anatomopathological and haematological studies. Brazilian Journal of Poultry Science 2007; 9:133-141.
Freitas OC, Mesquita AL, Paiva JB, Zotesso F, Berchieri Jr A. Control of Salmonella enterica serovar Enteritidis in laying hens by inactivated Salmonella Enteriditis vaccine. Brazilian Journal of Microbiology 2008; 39:390-396
Gast RK, Stone HD, Holt PS. Evaluation of the efficacy of oil-emulsion bacterins for reducing fecal shedding of Salmonella Enteritidis by laying hens. Avian Disease 1993; 37:1085-91
Gordon RF, Garside JS, Tucker JF. The use of living attenuated vaccines in the control of fowl typhoid. Veterinary Record 1959; 71:300-305.
Gordon WAM, Luke D. A note on the use of the 9R fowl typhoid vaccine in poultry breeding flocks. Veterinary Record 1959; 71:926-927.
Haider MG, Rahman MM, Hossain MM, Rashid M, Sufian MA, Islam MM, Haque AFM. Production of formalin killed fowl typhoid vaccine using local isolates of Salmonella Gallinarum in Bangladesh. Journal of Veterinary Medicine 2007; 5(1-2):33-38.
Hall WJ, Legenhausen DH, MacDonald AD. Studies on fowl typhoid 1 Nature and dissemination. Poultry Science 1949; 28:344-362.
Harbourne JF. The control of fowl typhoid in the field by the use of live vaccines. Veterinary Record 1957; 69:1102-1107.
Hassan JO, Curtis R. Development and evaluation of an experimental vaccination program using a live avirulent Salmonella Typhimurium strain to protect immunized chickens against challenge with homologous and heterologous Salmonella serotypes. Infection and Immunity 1994; 62:5519-5527.
Kingsley RA, Baumler AJ. Salmonella interactions with professional phagocytes In: Oelschlaeger TA, Hacker J. Bacterial invasion into eukaryotic cells. New York: Klumer Academic/Plenum; 2000. p321-342.
Lee YJ, Kim KS, Kwon YK, Tak RB. Biochemical characteristics and antimicrobial susceptibility of Salmonella Gallinarum isolated in Korea. Journal of Veterinary Science 2003; 4:161-166
Lee YJ, Mo IP, Kang MS. Safetu and efficacy of Salmonella Gallinarum 9R vaccine in young laying chickens. Avian Pathology 2005; 34(4):362-366.
Liu W, Yang Y, Chung N, Kwang J. Induction of humoral immune responses and protective immunity in chickens against Salmonella Enteritidis after a single dose of killed bacterium-loaded microspheres. Avian Diseases 2001; 45:797-806.
Mastroeni P, Villarreal-Ramos B, Hormaeche CE. Adoptive transfer of immuniti to oral challenge with virulent Salmonella in innately susceptible BALB/c mice requires both immune serum and T cells. Infection and Immunity 1993; 61:3981-3984.
Meyer H, Barrow PA, Pardon P. Salmonella immunization in animals. Proceedings of the International Symposium on Salmonella and Salmonellosis; 1992 sept 15-17. Ploufragan, FRA. p.345-374.
Miyamoto T, Kitaoka GS, Withanage T, Fukata K, Sasai E. Evaluation of the efficacy of Salmonella enteriditis oil-emulsion bacterin in an intravaginal challenge model in hens. Avian Diseases 1999; 43:497-505.
Nakamura M, Nagamine N, Takahashi T, SuzukiS,Sato S. Evaluation of the efficacy of a bacterin against Salmonella enteriditis infection and the effect of stress after vaccination. Avian Diseases 1994; 38:717-724.
Nagaraja KV, Rajshekara G. Vaccination against Salmonella enterica serovar Enteritidis infection: dilemma and realities In: Saeed AM, editors. Salmonella enterica serovar Enteritidis in humans and animals. Ames: Iowa Stae University Press; 1999. p.397-404.
Nassar TJ, al-Nakhli HM, al-Ogaily ZH. Use of Live and Inactivated Salmonella enteritidis phage type 4 vccines to immunise laying hens against experimental infection. Reviws in Science and Technology Office International de Epizootiologie 1994; 13:855-67.
Norton ECG, Lozano F. Evaluación económica del uso de uma bacterina contra Salmonella Enteritidis en ponedoras comercials. Anais do 15th Congresso Latino Americano de Avicultura; 1997; Cancún, MEX. p.252-254.
Oliveira GH, Fernandes AC, Berchieri Jr A. Experimental infection of laying hen with Salmonella Gallinarum. Brazilian Journal of Microbilogy 2005; 36:51-56.
Pomeroy BS, Nagaraja KV. Fowl typhoid In: calnek BW, Barnes HJ, Beard CW, Reid WM, Yoder HW, editors. Poultry disease. Ames: Iowa State University Press; 1991. p.87-98.
Schaller G. Decision criteria for vaccination against Salmonella in poultry. Acta Veterinaria Scandinavia 1994; 90(suppl):69-71.
Shivaprasad HL. Fowl typhoid and pullorum disease. Review in Scientific Techologies (OIE) 2000; 19(2):405-424.
Shivaprasad HL. Pullorum disease and fowl typhoid In: Saif YM, Barnes HJ, Fadly AM, Glisson JR, McDoulgald LR, Swayne DE, editors. Diseases of poultry. Ames: Iowa State Press; 2003. p.568-582.
Silva EN, Snoeyenbos GH, Weinack OM and Smyer CF. Studies on the use of 9R strain of Salmonella gallinarum as a vacine in chickens. Avian Diseases 1981; 25:38-52.
Silva EN. The Salmonella gallinarum problem in Central and South America. Proceedings of the International Symposium on Salmonella; 1984; New Orleans. p.150-156.
Smith HW. The use of live vaccines in experimental Salmonella gallinarum infections in chickens with observations on their interference effect. Journal of Hygiene 1956a; 54: 419-432.
Smith HW. The immunity to Salmonella Gallinarum infection in chickens produced by live cultures of members of the Salmonella genus. The Journal of Hygiene 1956b; 54:433-439.
Tan TZ, Nay B, Bricker JM, Huges H, Sterner F, Hein R. An attenuated Salmonella gallinarum live vaccine induces long term protection against Salmonella enteriditis challenge in chickens [cited 2000 dec 30]. Available from: http://www.safe-poultrycom/publicationsasp.
Tan TZ, Nay B, Bricker JM, Witvliet M, Hughes H, Sterner F, Hein R. Safety Studies and risk analysis of an attenuated Salmonella gallinarum live vaccine for layer chickens [cited 2000 dec 30]. Available from: http://wwwsafe-poultrycom/publiscationsasp.
Timms LM, Marshall RN, Breslin MF. Laboratory assessment of protection given by an experimental Salmonella enteritidis PT4 inactivated adjunt vaccine. Veterinary Record 1990; 127:611-614.
Timms LM, Marshall RN, Breslin MF. Laboratory -trial and field assessment of protection given by Salmonella enteritidis PT4 inactivated adjuvant vaccine British.. Veterinary Journal 1994; 150:93-102.
Van Immersel F, Methner U, Rvchlik I, Velge P, Martin G, Foster N, Ducatelle R, Barrow PA. Vaccination and early protection against hostspecific Salmonella serotypes in poultry: exploitation of innate and microbial activity. Epidemiology and Infection 2005; 33:959-978.
Wigley P, Hulme SD, Bumstead N, Barrow PA. In vivo and in vitro studies of genetic resistance to systemic salmonellosis in the chicken encoded by SALI locus. Microbes and Infection 2002;4(11):1111-1120.
Wigley P. Genetic resistance to Salmonella infection in domestic animals. Research in Veterinary Science 2004; 76:165-169.
Wigley P, Hulme S, Powers C, Beal R, Smith A, Barrow P. Oral infection with Salmonella enterica serovar Gallinarum 9R attenuated live vaccine as a model to characterise immunity to fowl typhoid in the chicken. BMC Veterinary Research 2005; 1:1-6.
Zancan FB, berchieri Jr A, Fernandes SA, Gama NMSQ. Salmonella spp investigation in transport box of day old birds. Brazilian Journal of Microbiology 2000; 31:230-232.
Zhang-Barber L, Turner AK, Barrow PA. Vaccination for control of Salmonella in poultry. Vaccine 1999; 17:2538-2545.

 Corporate Website
Corporate Website
 Africa
Africa
 Argentina
Argentina
 Asia
Asia
 Australia
Australia
 Belgium
Belgium
 Brazil
Brazil
 Bulgaria
Bulgaria
 Canada (EN)
Canada (EN)
 Chile
Chile
 China
China
 Colombia
Colombia
 Denmark
Denmark
 Egypt
Egypt
 France
France
 Germany
Germany
 Greece
Greece
 Hungary
Hungary
 Indonesia
Indonesia
 Italia
Italia
 India
India
 Japan
Japan
 Korea
Korea
 Malaysia
Malaysia
 Mexico
Mexico
 Middle East
Middle East
 Netherlands
Netherlands
 Peru
Peru
 Philippines
Philippines
 Poland
Poland
 Portugal
Portugal
 Romania
Romania
 Russia
Russia
 South Africa
South Africa
 Spain
Spain
 Sweden
Sweden
 Thailand
Thailand
 Tunisia
Tunisia
 Turkey
Turkey
 Ukraine
Ukraine
 United Kingdom
United Kingdom
 USA
USA
 Vietnam
Vietnam