...
-->Giới thiệu
-->Kháng thể Mẹ truyền Di chuyển từ Gà mái mẹ sang Phôi
-->MDA Chống lại các Tác nhân Gây bệnh Đặc biệt
-->Vi-Rút Gây bệnh Newcastle (NDV: Newcastle Disease virus)
-->Vi-rút Gây bệnh Viêm Phế quản Truyền nhiễm (IBV: Infectious Bronchitis virus)
-->Vi-rút Gây bệnh Viêm Thanh Khí quản Truyền nhiễm (LTV: Infectious Laryngotracheitis virus)
...
MIỄN DỊCH THỤ ĐỘNG: PHẦN 1
(Passive Immunity: Part 1)
Tác giả: Tiến sĩ Roberto SOARES, DVM, MSc., ACPV – Ceva Santé Animale – Libourne, Pháp
.
Giới thiệu
Kháng thể mẹ truyền (Maternal Derived Antibodies: MDA) là một loại miễn dịch thụ động tự nhiên - đây là hình thức các globulin miễn dịch chuyển từ một cá thể này sang một cá thể khác (từ mẹ truyền sang con). Gà mẹ sẽ tạo ra kháng thể khi được chủng ngừa hoặc nhiễm bệnh tự nhiên trong môi trường nuôi và kháng thể này sẽ được truyền sang đời con của nó thông qua trứng.
Miễn dịch thụ động thường chỉ có tác động bảo hộ trong một thời gian tương đối ngắn, kéo dài 1 đến 2 tuần (nhiều nhất là 4 tuần), vì thế, gà con sẽ chỉ được bảo vệ khỏi bệnh trong một vài tuần đầu khi hệ thống miễn dịch của chúng chưa được phát triển hoàn thiện. Các kháng thể mẹ truyền này sẽ đảm nhận vai trò bảo hộ đàn gà con trước các tác nhân gây bệnh giai đoạn sớm.
.
Kháng thể Mẹ truyền Di chuyển từ Gà mái Mẹ sang Phôi
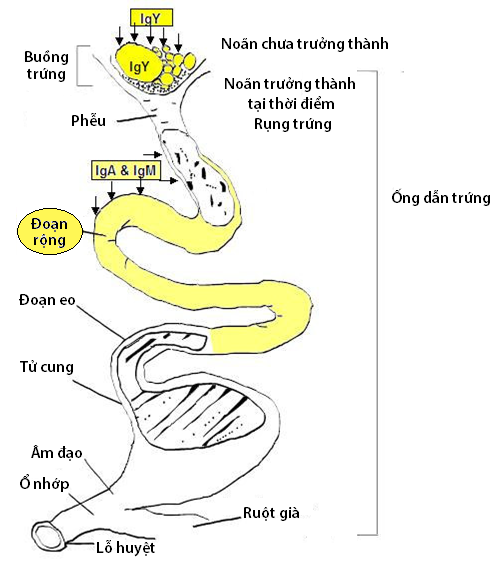
Sự chuyển kháng thể từ cơ thể gà mẹ đến phôi xảy ra qua hai bước. Đầu tiên, các kháng thể được làm lắng đọng trong lòng đỏ trứng và albumin (lòng trắng trứng) và sau đó, mới được chuyển vào trong phôi.
a. MDA Di chuyển từ Gà mái Mẹ đến Trứng
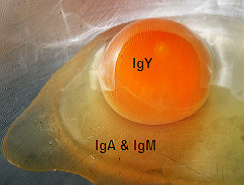
Gà mái mẹ truyền kháng thể vào trứng bằng cách vận chuyển các kháng thể (IgY, IgA và IgM) vào lòng đỏ trứng và albumin. Vì cấu trúc phân tử IgG của loài gà dài hơn các IgG của thú có vú khác, nên IgG của gà thường được một số tác giả gọi là IgY. Tuy nhiên, IgG gia cầm (hay IgY) đều có chức năng tương tự như các IgG của động vật có vú (Sharma, 1997). Các globulin miễn dịch (Immunoglobulin: Ig) khác nhau sẽ có con đường di chuyển vào trứng khác nhau.
IgY là loại Ig chiếm ưu thế nhất trong lòng đỏ trứng. Ig này được tiết ra bởi buồng trứng và di chuyển vào noãn đang phát triển (lòng đỏ).
Số lượng IgY đi vào noãn được quy định bởi biểu mô nang trứng, vì hình thái của lớp biểu mô này sẽ thay đổi khi noãn tăng trưởng. Biểu mô nang trứng sẽ trở nên phẳng hơn và mỏng hơn khi noãn phát triển to ra và chính điều này đã giúp phần lớn IgY chui vào được bên trong. Việc chuyển IgY qua biểu mô nang trứng vào bên trong noãn đạt mức cao nhất vào thời điểm 3 đến 4 ngày trước khi rụng trứng và bắt đầu giảm dần do sự phát triển của màng noãn hoàng giữa tế bào trứng và lớp biểu mô nang của buồng trứng để chuẩn bị cho sự rụng trứng tiếp theo.
Thông thường, một con gà mái sẽ mang cùng lúc nhiều trứng có các giai đoạn phát triển khác nhau, vì thế số lượng IgY di chuyển vào bên trong số lượng trứng này cũng không giống nhau.
IgA và IgM chủ yếu tìm thấy trong lòng trắng albumin (Rose và cộng sự, 1974). Hai loại Ig này được chuyển vào lòng trắng nhờ sự bài tiết niêm mạc trong ống dẫn trứng, cụ thể hơn là trong đoạn rộng (magnum) của ống dẫn trứng.
Hình 1 MDA Di chuyển từ Gà mái đến Trứng
.
b. MDA Di chuyển từ Trứng đến Phôi
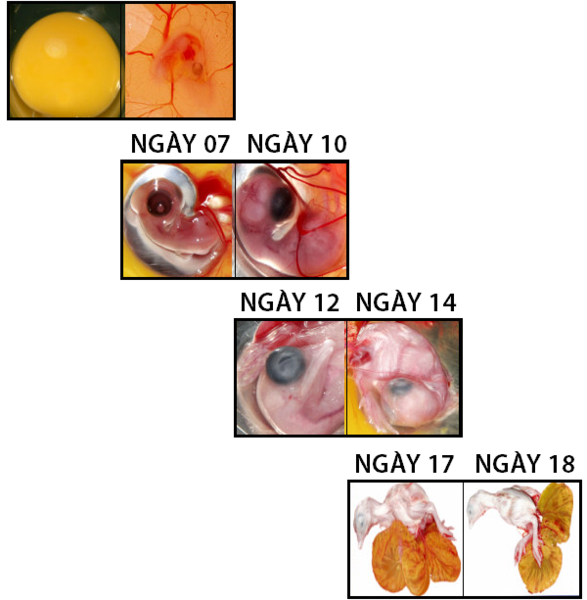
IgY được chuyển từ lòng đỏ trứng sang phôi thông qua quá trình trao đổi chất. Quá trình này bắt đầu từ ngày thứ 7 phát triển của phôi và đạt mức cao nhất ở thời điểm 3 đến 4 ngày trước khi nở.
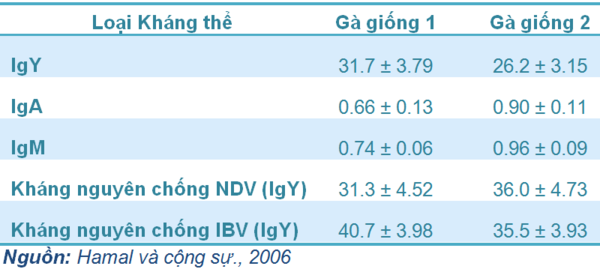
Số lượng IgY chuyển đến lòng đỏ trứng và từ lòng đỏ đến phôi có mối quan hệ tỉ lệ thuận với nồng độ IgY trong huyết tương của gà mẹ. Trong một nghiên cứu của Hamal và cộng sự (2006), họ đã tìm thấy 27 đến 30% IgY của gà mẹ được chuyển cho các con của nó (Bảng 1)
Hình 2 Vị trí hiện diện của IgY, IgA & IgM trong trứng
Hình 3 Sự phát triển của phôi
IgA và IgM được chuyển vào phôi nhờ cơ chế hấp thụ lòng trắng của ruột phôi và có thể thực hiện chức năng chính trên gà con mới nở như một Ig bảo vệ trong đường tiêu hóa hoặc như một nguồn bổ sung protein.
Số lượng IgA và IgM chuyển sang đời sau thường ít hơn 1% trong nồng độ của hai loại Ig này trong huyết tương gà mẹ (như Bảng 1). IgM là loại Ig chuyển vào phôi ít nhất trong số 3 loại Ig, nhưng đây lại là loại Ig được gà con mới nở tổng hợp đầu tiên, tiếp theo sau đó mới là IgA và IgY.
.
MDA Chống lại các Tác nhân Gây bệnh Đặc biệt
Tác động bảo hộ của MDA có thể thay đổi giữa các gà con và phụ thuộc vào nhiều yếu tố khác như hàm lượng MDA và tác nhân gây bệnh đang hiện diện. Trong bài này, chúng ta sẽ tập trung vào ba loại MDA của ba tác nhân gây bệnh chính trên đường hô hấp là vi-rút gây bệnh Dịch tả Gà (Newcastle Disease virus, NDV), Viêm Phế quản Truyền nhiễm (Infectious Bronchitis virus: IBV) và Viêm Thanh - Khí quản Truyền nhiễm (Infectious Laryngotracheitis virus: LTV).
Tuy nhiên, điều quan trọng nên biết: nhiều nước vẫn tiến hành chủng ngừa vắc-xin kiểm soát bệnh Dịch tả Gà và Viêm Phế quản Truyền nhiễm bằng lồng phun trong trại ấp, ngay cả khi các gà con đã có kháng thể mẹ truyền chống lại hai bệnh này trong cơ thể. Lý do để các nước này phải thực hiện việc chủng ngừa sớm là để kích thích các đáp ứng miễn dịch cục bộ nhằm tăng cường khả năng bảo hộ gà con trước hai bệnh ND và IB (kháng thể mẹ truyền thường chỉ có tác dụng khi tác nhân gây bệnh vào được bên trong cơ thể).
Bảng 1 Nồng độ Ig trong huyết tương của đời sau dưới dạng phần trăm theo nồng độ Ig trong huyết tương gà mẹ
.
Vi-Rút Gây bệnh Newcastle (NDV: Newcastle Disease Virus)
Kháng thể đặc hiệu với NDV được nhận từ gà mẹ sẽ cung cấp khả năng bảo hộ cho đàn gà con. Hamal và cộng sự (2006) đã tìm thấy hàm lượng kháng thể đặc hiệu với NDV từ gà mẹ chuyển sang đời sau nằm trong khoảng 27 đến 40% và có mối liên quan trực tiếp với hiệu giá kháng thể trong gà mẹ (ở Bảng 1). IgY cũng được tìm thấy trong nước mắt của gà con một ngày tuổi ở mức 1:5 so với mức kháng thể trong huyết tương (Russell, 1992).
MDA đặc hiệu với ND bắt đầu bị mất dần ngay khi gà con nở. Theo Allan và cộng sự (1978), cứ mỗi 4 ngày rưỡi, hai phần MDA trong gà con sẽ bị phân hủy.
Trong các gà con có lượng MDA cao, việc bảo hộ từ MDA đặc hiệu với ND sẽ làm ảnh hưởng đến sự nhân lên của vi-rút trong vắc-xin. Chính vì thế, chỉ ở những gà con có lượng MDA thấp, việc chủng ngừa vắc-xin sống ND vào lúc một ngày tuổi mới kích thích tốt hệ thống miễn dịch cục bộ (miễn dịch qua trung gian tế bào) trên đường hô hấp trên và tạo được sự bảo hộ sớm cho gà con.
Vắc-xin vô hoạt nhũ tương dầu đã được sử dụng thành công trên gà con một ngày tuổi có sẵn hàm lượng MDA nhất định chống lại NDV (Alexander and Jones, 2001). Những lợi thế chính của các vắc-xin bất hoạt chính là có rất ít các phản ứng bất lợi trên gà chủng ngừa và chúng nhận được hàm lượng kháng thể bảo hộ rất cao trong thời gian dài (Alexander and Jones, 2003).
Hơn nữa, những vắc-xin bất hoạt nhũ tương dầu không bị những ảnh hưởng bất lợi của MDA như vắc-xin sống (Box và cộng sự, 1976) vì nhũ tương dầu có tác dụng như một chất kích thích cơ chế miễn dịch và giúp kháng nguyên bên trong được phân rã từ từ. Trong những trường hợp này, có một kích thích tích cực của miễn dịch chủ động trong khi miễn dịch thụ động giảm từ từ và hệ thống miễn dịch dần dần được hoàn thiện (Bennejean và cộng sự, 1978; Box và cộng sự, 1976; Warden và cộng sự, 1975.)
.
Vi-rút Gây bệnh Viêm Phế quản Truyền nhiễm (IBV: Infectious Bronchitis Virus)
Kháng thể MDA đặc hiệu chống lại IBV khác nhau từ đàn này sang đàn khác và điều này chủ yếu do các yếu tố ảnh hưởng từ chủng vi-rút sử dụng trong vắc-xin, chương trình chủng ngừa trong trại, chất lượng quy trình chủng ngừa, quy mô sản xuất trong trại và bản thân gà đã chủng ngừa. Phần trăm IgY đặc hiệu với IBV chuyển từ gà mái sang đời sau nằm trong khoảng 31 đến 41% (xem Bảng 1).
MDA chống IBV được chứng minh là có khả năng bảo hộ. Mondal và Naqi (2001) quan sát thấy gà con có hiệu giá kháng thể MDA chống lại IBV cao sẽ có hơn 95% khả năng bảo hộ khi bị công cường độc lúc một ngày tuổi, tuy nhiên, lượng MDA chống lại IBV này có thể suy giảm nhanh chóng. Các nhà nghiên cứu thấy rằng: khả năng bảo hộ bảy ngàu sau đó trên gà con chỉ còn ít hơn 30%. Kết quả này cũng giống với kết luận thí nghiệm của Hamal và cộng sự (2006), khi quan sát thấy: lượng MDA giảm đáng kể vào ngày thứ bảy và hoàn toàn không còn khả năng bảo hộ vào ngày 14.
Các tác giả trên đều kết luận: khả năng bảo hộ mạnh mẽ trên gà con đối với IBV do mức bảo hộ cao của miễn dịch cục bộ. Chính vì điều này, việc chủng ngừa IBV trên gà con một ngày tuổi có sẵn MDA được thực hiện rất thường xuyên, mặc kệ rằng sẽ xảy ra hiện tượng giảm đáp ứng miễn dịch dịch thể trên các gà con có lượng MDA cao.
Talebi và cộng sự (2005) tìm thấy rằng: MDA chống lại IBV của gà con không được chủng ngừa sẽ có lượng MDA giảm nhanh hơn (chỉ còn một nửa sau 5 ngày) so với gà con được chủng ngừa vào ngày thứ nhất với vắc-xin chứa chủng H120 của IBV bằng đường phun sương, nhỏ mắt và pha nước uống (còn một nửa sau 6 ngày).
Trong các quốc gia có chủng IB biến thể, các gà giống nên được chủng ngừa với các chủng IBV đang có trong trại để sản xuất các MDA đặc hiệu hơn.
.
Vi-rút Gây bệnh Viêm Thanh Khí quản Truyền nhiễm (LTV: Infectious Laryngotracheitis virus)
Đời sau của các gà giống được chủng ngừa với vi-rút gây bệnh LT sẽ có được MDA chuyển qua trứng. Tuy nhiên, lượng MDA này không có khả năng bảo hộ chống lại việc nhiễm bệnh cũng như không hề gây trở ngại cho các vi-rút trong vắc-xin khi chủng ngừa cho các gà con (Fahey và cộng sự, 1983).
Davison và cộng sự (1983) đánh giá khả năng bảo hộ từ các MDA đặc hiệu với LT trong suốt 4 tuần đầu tiên của gà con và thấy rằng gà con trong các độ tuổi thí nghiệm (1, 7, 14, 21 và 28 ngày) đều dễ bị nhiễm bệnh.
Thật tế, vì việc nhiễm LTV thường chỉ giới hạn ở đường hô hấp trên và hiện tượng vi-rút xâm nhập vào máu không xảy ra nên lúc này các MDA đang có sẵn trong huyết tương không thể hoạt động để tạo sự bảo hộ chống lại sự nhiễm bệnh này. Khả năng bảo hộ trước LTV dường như chỉ trông cậy vào mỗi đáp ứng miễn dịch qua trung gian tế bào. Vì vậy, từ các điểm này nên các chuyên gia đều xem xét kỹ lưỡng tình hình nhiễm bệnh trong trại để phát triển một chiến lược chủng ngừa hiệu quả trước sự xâm nhiễm của LTV.
.
TÀI LIỆU THAM KHẢO
Alexander, D.J and Jones, R.C. 2001. Newcastle Disease. In: F.T.W Jordan (Ed.) Poultry Diseases, 5th Edition, WB Sanders.
Alexander, D.J and Jones, R.C. 2003. Newcastle Disease, Other Avian Paramyxovirus, and Pneumovirus Infections. In: Y.M. Saif (Ed.) Diseases of Poultry, 11th Edition, p. 63-92. Iowa State Press.
Allan, W. H., J. E. Lancaster, and B. Toth. 1978. Newcastle disease vaccines—Their production and use. FAO Animal Production and Health Series No. 10. FAO: Rome, Italy.
Bennejean, G., Guittet, M., Picault, J.P., Bouquet, J.F., Devaux, B., Gaudry, D. Moreau, Y. 1978. Vaccination of day-old chicks against Newcastle Disease using inactivated oil adjuvant vaccine and/or live vaccine. Avian Pathology, v. 7, n.1, p. 15-27.
Box, P.G., Furminger, I.G.S., Robertson, W.W, Warden, D. 1976. The effect of Marek’s Disease vaccination on immunity of day-old chicks against Newcastle Disease, using B1 and oil emulsion vaccine. Avian Pathology, v.5, p. 299-305.
Cardoso, W.M. , Gomes, L.P. , Romão, J.M.,. Salles, R.P.R., Teixeira, R.S.C, Sobral, M.H.N.R., Câmara, S.R., Oliveira, W.F. 2006. Antibodies specific to infectious bronchitis in broilers in Ceará state, Brazil. Arq. Bras. Med. Vet. Zootec., v.58, n.3, p.327-332
Davison, S., Smith, G., Eckroade, R.J. 1989. Laryngotracheitis in Chickens: Infectious Studies and the Efficacy of Tissue-Culture vaccine in chicks less than four weeks Age. Avian Diseases 33: 24-29.
Fahey KJ, Bagust TJ, York JJ. 1983. Laryngotracheitis herpesvirus infection in the chicken:The role of humoral antibody in immunity to a graded challenge infection. Avian Pathology: 12:505-514.
Hamal, K.R., Burgess, S.C., Pevzner, I.Y. and Erf, G.F. 2006. Maternal Antibody Transfer from Dams to Their Egg Yolks, Egg Whites, and Chicks in Meat Lines of Chickens. Poultry Science 85:1364–1372
Heller, E. D., D. B. Nathan, and M. Perek. 1977. The transfer of Newcastle serum antibody from the laying hen to the egg and chick. Res Vet Sci 22:376—379.
Hidalgo, H. 2003. Infectious Laryngotracheitis: A Review. Brazilian Journal of Poultry Science : v.5 , n.3, p. 157 – 168
Hussell, P.H. 1993. Newcastle Disease Virus: virus replication in the Harderian gland stimulates lacrimal IgA, the yolk sac provides early lacrimal IgG. Vet. Immunol. Immunopathol., 37: 151-163.
Kramer, T. T., and H. C. Cho. 1970. Transfer of immunoglobulins and antibodies in the hens egg. Immunology 19:157–167.
Leslie, G. A., and W. L. Clem. 1969. Phylogeny of immunoglobulin structure and function. 3. Immunoglobulins of the chicken. J. Exp. Med. 130:1337–1352.
Mondal, S.P.; Naqi, S.A. 2001. Maternal antibody to infectious bronchitis virus: its role in protection against infection and development of active immunity to vaccine. Vet. Immunol. Immunopathol., v.79, p.31-40.
Patterson, R. , Youngner, J.S., Weigle, W.O. and Dixon, F. J. 1962. The Metabolism of Serum Proteins in the Hen and Chick and Secretion of Serum Proteins by the Ovary of the Hen. The Journal of General Physiology 45:501-513
Sharma, J.M. 1997. The structure and function of the avian immune system. Acta Veterinaria Hungarica, v. 45, n. 3, p.229-238.
Talebi,A., Pourbakhsh, S.A., and Dorostkar, K. 2005. Effects of Vaccination Routes Against IB on Performance and Immune Responses of Broiler Chickens. Intern. J. of Poultry Science 4 (10): 795-798.
Rose, M. E., E. Orlans, and N. Buttress. 1974. Immunoglobulin classes in the hen’s egg: Their segregation in yolk and white. Eur. J. Immunol. 4:521–523.
Warden, D. Furminger, I.G.S., Robertson, W.W. 1975. Immunizing Chicks against Newcastle Disease by Concurrent Inactivated Oilemulsion and Live B1 Vaccines. Veterinary Record, v.18, p. 65-66.

 Corporate Website
Corporate Website
 Africa
Africa
 Argentina
Argentina
 Asia
Asia
 Australia
Australia
 Belgium
Belgium
 Brazil
Brazil
 Bulgaria
Bulgaria
 Canada (EN)
Canada (EN)
 Chile
Chile
 China
China
 Colombia
Colombia
 Denmark
Denmark
 Egypt
Egypt
 France
France
 Germany
Germany
 Greece
Greece
 Hungary
Hungary
 Indonesia
Indonesia
 Italia
Italia
 India
India
 Japan
Japan
 Korea
Korea
 Malaysia
Malaysia
 Mexico
Mexico
 Middle East
Middle East
 Netherlands
Netherlands
 Peru
Peru
 Philippines
Philippines
 Poland
Poland
 Portugal
Portugal
 Romania
Romania
 Russia
Russia
 South Africa
South Africa
 Spain
Spain
 Sweden
Sweden
 Thailand
Thailand
 Tunisia
Tunisia
 Turkey
Turkey
 Ukraine
Ukraine
 United Kingdom
United Kingdom
 USA
USA
 Vietnam
Vietnam