...
--> Giới thiệu
--> Vắc-xin sống hay vắc-xin bất hoạt?
--> Sự miễn dịch
--> Dòng vắc-xin
-->Kết luận
...
CHỦNG NGỪA PHÒNG BỆNH NEWCASTLE TRONG TRẠI ẤP
(VACCINATION AGAINST NEWCASTLE DISEASE IN THE HATCHERIES)
Tác giả: Marcelo PANIAGO, DVM, MSc, MBA, Giám đốc Thị trường khu vực về Gia cầm
CEVA Animal Health Châu Á - Thái Bình Dương - Petaling Jaya, Selangor, Malaysia
.
GIỚI THIỆU
Bệnh Newcastle (Newcastle Disease: ND) là bệnh truyền nhiễm cấp tính với nhiều chủng gây bệnh khác nhau và mức độ biểu hiện triệu chứng phụ thuộc vào chủng gây bệnh. Đây là một trong những rào cản chính khi giao dịch với quốc tế về gia cầm và các sản phẩm của gia cầm vì độc lực của ND có tầm ảnh hưởng rất lớn trên toàn thế giới. Ở châu Á, bệnh mang tính dịch vùng và liên tục thách thức các bác sĩ thú y, kể cả người giàu kinh nghiệm.
Chủng ngừa đóng vai trò quan trọng trong việc phòng ngừa ND. Tuy nhiên, không có chương trình chủng ngừa nào được xem là lý tưởng trong mọi trường hợp vì còn phụ thuộc vào mức độ dịch bệnh xảy ra trong vùng, chính sách kiểm soát bệnh trong nước, loại gia cầm (nuôi lấy thịt hay lấy trứng), chủng vắc-xin, kích cỡ đàn, chương trình tiêm phòng áp dụng trước đó,… Mặc dù vậy, chủng ngừa trong trại ấp đã được áp dụng trên toàn thế giới đối với giống hướng thịt, hướng trứng và gia cầm giống.
.
VẮC-XIN SỐNG HAY VẮC-XIN BẤT HOẠT?
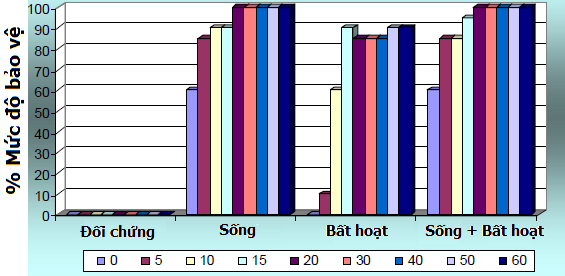
Kể từ cuối thập niên 60, hiệu quả của việc phối hợp vắc-xin sống và vắc-xin bất hoạt để phòng ngừa ND ở trại ấp đã được triển khai nghiên cứu. Vào năm 1978, một trong những thí nghiệm của Bennejean và các cộng sự đã nghiên cứu sâu hơn về vấn đề chủng ngừa trong trại ấp. Các gà con một ngày tuổi sạch mầm bệnh (SPF: Specific Pathogen Free - không mang mầm bệnh chuyên biệt) được chia thành bốn nhóm. Nhóm đầu tiên được chủng ngừa vắc-xin sống qua đường mắt, nhóm thứ hai tiêm dưới da vắc-xin bất hoạt và nhóm thứ ba được nhận đồng thời vắc-xin sống và vắc-xin bất hoạt. Nhóm cuối cùng được giữ làm đối chứng. Sau đó, các nhóm này được công cường độc qua đường mắt, sử dụng dòng Ploufragan vào ngày 0, 5, 10, 15, 20, 30, 40, 50 và 60 sau khi thực hiện chủng ngừa. Kết quả được mô tả như biểu đồ 1.
Biểu đồ 1 Mức độ bảo vệ sau khi công cường độc ở gà con SPF
Ngay ở thời điểm ngày 0 (chỉ 4 giờ sau khi chủng ngừa), gà con được chủng vắc-xin sống đã nhận được mức bảo vệ là 60%. Đây cũng là mức bảo vệ khi gà con được chủng ngừa phối hợp vắc-xin sống và vắc-xin bất hoạt. Tuy nhiên, ở nhóm đối chứng và nhóm tiêm phòng với vắc-xin bất hoạt không thấy sự bảo hộ nào ở ngày 0. Không nghi ngờ gì nữa, sự bảo vệ xuất hiện do hệ thống miễn dịch cục bộ được kích hoạt bởi vắc-xin sống. Trong khi, vắc-xin bất hoạt không thể kích thích sự bảo vệ từ hệ thống miễn dịch cục bộ này, nên các gà con được tiêm phòng bằng vắc-xin bất hoạt đã không có bất kì sự bảo hộ nào vào ngày 0.
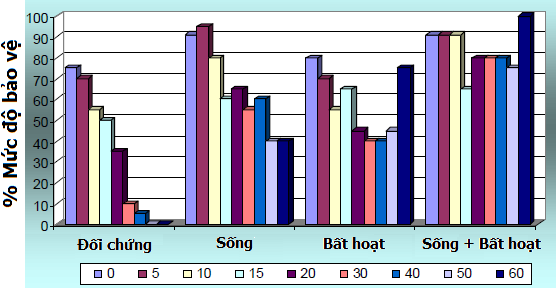
Một thí nghiệm khác được thực hiện tương tự với bốn nhóm gà con một ngày tuổi thương phẩm (DOC: Day-Old Chick) có mức kháng thể mẹ truyền cao. Chúng cũng được chia ra để chủng ngừa với vắc-xin sống, bất hoạt hay phối hợp cả hai loại này. Nhóm đối chứng không được chủng ngừa bất kì vắc-xin nào. Công cường độc được thực hiện giống như thí nghiệm trước, bắt đầu từ ngày 0 (sau khi chủng ngừa bốn giờ) cho đến ngày 60 và kết quả được tóm tắt như biểu đồ 2.
Biểu đồ 2 Mức độ bảo vệ sau khi công cường độc ở gà con DOC có kháng thể mẹ truyền
Trong trường hợp này, nhóm đối chứng cũng thấy được vài sự bảo vệ và giảm dần theo thời gian vì mức kháng thể mẹ truyền bị suy giảm. Ngay từ thời điểm 4 giờ sau khi tiêm phòng, nhóm nhận được vắc-xin sống cho thấy mức bảo hộ tốt hơn khi so sánh với nhóm đối chứng. Sự khác biệt này cũng được thấy ở nhóm tiêm vắc-xin sống kết hợp với vắc-xin bất hoạt. Nói tóm lại, sự bảo hộ tốt nhất trong thí nghiệm này là ở nhóm nhận được sự bảo vệ đồng thời của vắc-xin sống và vắc-xin bất hoạt.
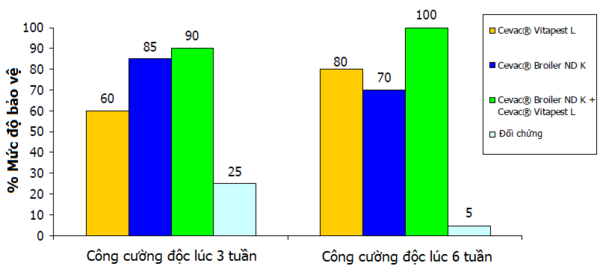
CEVA Santé Animale cũng triển khai nghiên cứu sự phối hợp vắc-xin sống và vắc-xin bất hoạt ở trại ấp. Một trong những thí nghiệm này là ước lượng sự bảo hộ khi sử dụng phối hợp Cevac® Vitapest L (vắc-xin sống) và Cevac® Broiler ND K (vắc-xin bất hoạt) trước khi công cường độc với ND. Gà con hướng thịt một ngày tuổi được tiêm phòng ở trại ấp chỉ sử dụng Cevac® Vitapest L hoặc Cevac® Broiler ND K hay kết hợp sử dụng Cevac® Vitapest L + Cevac® Broiler ND K. Vào ngày 21 và ngày 42, được công cường độc qua đường tiêm bắp với dòng 106 ELD50 của chủng Hertz 33. Sau đó, 20 con được chọn lấy mẫu và gửi về phòng thí nghiệm.
Kết quả có thể được nhìn thấy ở biểu đồ 3.
Biểu đồ 3 Hiệu quả chủng ngừa: mức độ bảo vệ trước bệnh ND
Cũng như thí nghiệm của Bennejean và cộng sự, phối hợp vắc-xin sống (Cevac® Vitapest L) và vắc-xin bất hoạt (Cevac® Broiler ND K) đem lại sự bảo hộ cao nhất dù bị công cường độc vào bất kì lúc nào (3 hay 6 tuần).
.
SỰ MIỄN DỊCH
Sử dụng vắc-xin ND sống ở trại ấp đem lại rất nhiều thuận lợi vì kích hoạt hệ thống miễn dịch cục bộ trên đường hô hấp bằng cách ngăn ngừa hay làm giảm sự nhân lên của vi-rút trên biểu mô hô hấp. Khả năng bảo vệ có được là do sự kết hợp của hệ thống miễn dịch qua trung gian tế bào (CMI: Cell-Mediate Immunity), kháng thể IgA và interferon. Mặt khác, sử dụng vắc-xin bất hoạt nhũ tương dầu thường gây ra rất ít phản ứng phụ trên gà và mang lại kháng thể bảo vệ ở mức cao trong thời gian dài.
Do đó, phối hợp giữa vắc-xin sống và vắc-xin bất hoạt rất được khuyến khích trong trường hợp áp lực bệnh ND cao ở vùng chăn nuôi vì vắc-xin sống sẽ kích thích hệ thống miễn dịch cục bộ có khả năng làm tăng sự bảo hộ ngay từ giai đoạn sớm của gà và vắc-xin bất hoạt sẽ đảm bảo kích hoạt hệ thống miễn dịch dịch thể ở mức cao và kéo dài.
.
DÒNG VẮC-XIN
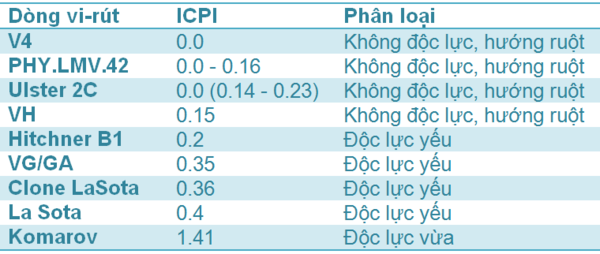
Một điểm quan trọng cần chú ý đến là chủng vi-rút trong vắc-xin sống được sử dụng trong trại ấp. Chủng vi-rút ND được phân loại dựa vào chỉ số ICPI (Intra-Cerebral Pathogenicity Index: Chỉ số gây bệnh khi tiêm vào não gà con một ngày tuổi) và ICPI càng cao thì phản ứng sau khi tiêm (PVR: Post-Vaccination Reactions) càng nghiêm trọng. Vì thế, sự thất bại do PVR là một lo lắng hàng đầu của người chăn nuôi. Thế nhưng, ngành công nghiệp gia cầm hiện đại không thể để mất các thuận lợi của phương pháp tiêm phòng do lo sợ các rủi ro có thể mắc phải khi áp dụng chương trình chủng ngừa trên đàn gà.
Một điều nên nhớ, đối với dòng độc lực yếu hướng hô hấp, chủng vi-rút nhân lên trên hệ thống hô hấp của gà và nơi này cũng thường bị kích thích do sự xuất hiện của bụi, amoniac và Mycoplasma gallisepticum. Do đó, các phản ứng PVR là không thể tránh khỏi. Như vậy, vấn đề cần được đặt ra là: nên sử dụng dòng vắc-xin nào để các phản ứng PVR xảy ra là chấp nhận được?
Bảng 1 Các dòng vắc-xin Newcastle
Vì các lý do này, các nhà sản xuất nghiên cứu và phát triển vắc-xin có khả năng bảo hộ và độ an toàn cùng một lúc. Các chủng không có độc lực, hướng ruột nhân lên chủ yếu ở đường tiêu hóa và do đó, chúng an toàn hơn các dòng độc lực yếu, hướng hô hấp. Hơn nữa, các dòng này cho hiệu quả như các dòng độc lực yếu.
Do đó, sử dụng các dòng không có độc lực, hướng ruột như Cevac® Vitapest L ở trại ấp ngày càng trở nên phổ biến và ở những trại có Mycoplasma còn hiện diện thì sử dụng dòng sản phẩm này là cần thiết để tránh các thiệt hại to lớn do phản ứng PVR.
.
KẾT LUẬN
Phối hợp sử dụng vắc-xin sống và vắc-xin bất hoạt phòng bệnh ND ở các gà con một ngày tuổi đem lại sự bảo vệ tốt hơn với kháng thể lưu hành trong máu ở mức cao và miễn dịch kéo dài sau khi công cường độc. Thuận lợi của sự phối hợp này là bảo hộ hoàn hảo trong bối cảnh có áp lực bệnh cao do khả năng bảo vệ mạnh mẽ và kéo dài khi phối hợp sự miễn dịch cục bộ được kích thích bởi vắc-xin sống nhược độc với miễn dịch dịch thể (kháng thể lưu hành trong máu) được kích thích bởi vắc-xin bất hoạt.
Tuy nhiên, cần phải xem xét đến chủng vi-rút đang xuất hiện và vấn đề tái chủng để phòng bệnh ND ở trang trại. Tuy nhiên, cũng cần phải nhấn mạnh rằng trong mọi trường hợp, thực hiện chương trình chủng ngừa có thể được xem như một phương pháp cần thiết để có được sự quản lý tốt, an toàn sinh học và vệ sinh tốt trong môi trường chăn nuôi gia cầm trong nước.
Cuối cùng, cũng nên lưu ý rằng kết quả chủng ngừa có thể bị ảnh hưởng rất lớn bởi phương cách thực hiện, độc tố mycotoxin, sự nhiễm vi-rút làm giảm sức đề kháng như bệnh Gumboro, bệnh Marek hay bệnh thiếu máu trên gà (CAV: Chicken Anemia virus) và các yếu tố khác từ môi trường. Tất cả các tác nhân này nên được kiểm soát để có được sự bảo vệ tốt nhất trước ND.
.
TÀI LIỆU THAM KHẢO
1. Alexander, D.J and Jones, R.C. 2001. Newcastle Disease. In: F.T.W Jordan (Ed.) Poultry Diseases, 5th Edition, WB Sanders.
2. Alexander, D.J and Jones, R.C. Newcastle Disease, Other Avian Paramyxovirus, and Pneumovirus Infections. 2003. In:
Y.M. Saif (Ed.) Diseases of Poultry, 11th Edition, p. 63-92. Iowa State Press.
3. Al-Garib, S.O., Gielkens, A.L.J., Gruys, E. and Koch,G. 2003. Review of Newcastle disease virus with particular references to immunity and vaccination. World’s Poultry Science Journal, V. 59, p. 185-200.
4. Bennejean, G. 1988. Newcastle Disease: Control Policies In: D.J Alexander (ed.). Newcastle Disease. Kluwer AcademyPublishers. 318-322
5. Bennejean, G., Guittet, M., Picault, J.P., Bouquet, J.F., Devaux, B., Gaudry, D. Moreau, Y. 1978. Vaccination of day-old chicks against Newcastle Disease using inactivated oil adjuvant vaccine and/or live vaccine. Avian Pathology, v. 7, n.1, p. 15-27.
6. Box, P.G., Furminger, I.G.S., Robertson, W.W, Warden, D. 1976. The effect of Marek’s Disease vaccination on immunity of day-old chicks against Newcastle Disease, using B1 and oil emulsion vaccine. Avian Pathology, v.5, p. 299-305.
7. Brugh, J.R. and Siegel, H.S. 1978. Inactivated Newcastle Disease Vaccines: Influence of Virus Concentration on Primary Immune Response. Poultry Science, V. 57, p. 892-896.
8. Ceva Sante Animale. Newcastle Disease. 2002. In: Corporate Communication Standards, SBD Biological BU, p. 2-35.
9. Maas, R.A., Oei, H.L., Venema-Kemper, S., Koch, G. and Bongers, J. 1999. Dose-Response Effects of Inactivated Newcastle Disease Vaccines: Influence of Serological Assay, Time After vaccination, and Type of Chickens. Avian Diseases, v. 43, p. 670-677.
10. Office International Des Epizooties (OIE). 2000. Newcastle Disease. In: Manual of Standards Diagnostic Tests and Vaccines, 4th Edition.
11. Reynolds, D.L. and Maraqa, A.D. 2000. Protective Immunity against Newcastle Disease: The Role of Cell-mediated Immunity. Avian Diseases, v. 44, p. 145-154.
12. Sharma, J.M. 1997. The structure and function of the avian immune system. Acta Veterinaria Hungarica, v. 45, n. 3, p.229-238.
13. Stone, H.D. Brugh, M. and Beard, C.W. 1983. Influence of Formulation on the Efficacy of Experimental Oil-Emulsion Newcastle Disease Vaccines. Avian Diseases, V. 27, n.3, p. 688-697
14. Warden, D. Furminger, I.G.S., Robertson, W.W. 1975. Immunizing Chicks against Newcastle Disease by Concurrent Inactivated Oil-emulsion and Live B1 Vaccines. Veterinary Record, v.18, p. 65-66.

 Corporate Website
Corporate Website
 Africa
Africa
 Argentina
Argentina
 Asia
Asia
 Australia
Australia
 Belgium
Belgium
 Brazil
Brazil
 Bulgaria
Bulgaria
 Canada (EN)
Canada (EN)
 Chile
Chile
 China
China
 Colombia
Colombia
 Denmark
Denmark
 Egypt
Egypt
 France
France
 Germany
Germany
 Greece
Greece
 Hungary
Hungary
 Indonesia
Indonesia
 Italia
Italia
 India
India
 Japan
Japan
 Korea
Korea
 Malaysia
Malaysia
 Mexico
Mexico
 Middle East
Middle East
 Netherlands
Netherlands
 Peru
Peru
 Philippines
Philippines
 Poland
Poland
 Portugal
Portugal
 Romania
Romania
 Russia
Russia
 South Africa
South Africa
 Spain
Spain
 Sweden
Sweden
 Thailand
Thailand
 Tunisia
Tunisia
 Turkey
Turkey
 Ukraine
Ukraine
 United Kingdom
United Kingdom
 USA
USA
 Vietnam
Vietnam